Wodór hamuje proliferację i migrację komórek raka żołądka poprzez modulację osi lncRNA MALAT1/miR-124-3p/EZH2
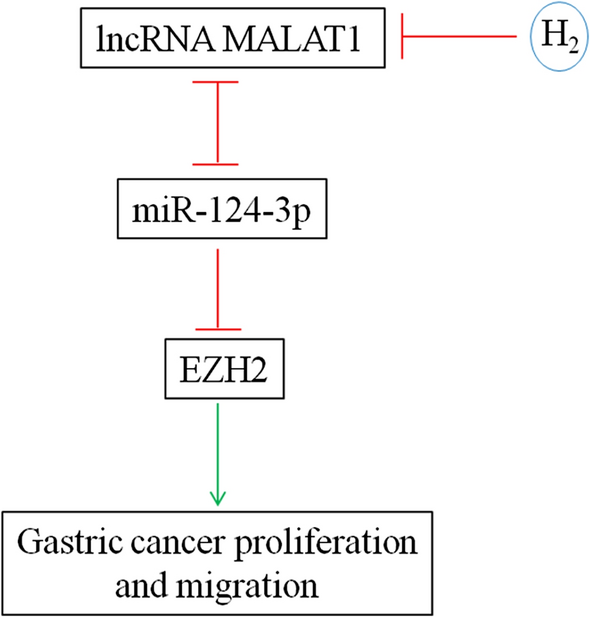
Badanie to wykazało skuteczność wodoru molekularnego w hamowaniu wzrostu raka żołądka poprzez zmniejszenie proliferacji i migracji komórek raka żołądka, co nastąpiło poprzez obniżenie poziomu lncRNA MALAT1 i członka rodziny grupy Polycomb EZH2 oraz zwiększenie poziomu miR-124-3p. Co więcej, miR-124-3p hamował ekspresję EZH2 i wzajemnie tłumił ekspresję siebie nawzajem za pomocą lncRNA MALAT1. Dane te wskazują, że H2 powinien być dalej badany pod kątem leczenia raka żołądka, a oś lncRNA MALAT1/miR-124-3p/EZH2 byłaby nowym celem interwencji.
Baocheng Zhu , Hengguan Cui i Weiqiang Xu
Międzynarodowa Organizacja Komórek Rakowych tom 21 , Numer artykułu: 70 ( 2021 )
Tło
Rak żołądka jest jednym z najpowszechniejszych i najbardziej śmiertelnych nowotworów złośliwych, dla którego nie ma skutecznej metody leczenia. Celem tego badania było zbadanie wpływu gazowego wodoru na zachowanie komórek raka żołądka.
Metody
Linie komórkowe raka żołądka MGC-803 i BGC-823 traktowano mieszaniną gazową H2/O2 lub bez niej ( 66,7 % :33,3% obj./obj.). Proliferację i migrację oceniano odpowiednio za pomocą testu MTT i testu gojenia ran poprzez zadrapanie. Ekspresję lncRNA MALAT1, miR-124-3p i EZH2 analizowano za pomocą ilościowej PCR w czasie rzeczywistym i/lub Western blot. Wzrost guza oszacowano przy użyciu mysiego modelu heteroprzeszczepu.
Wyniki
Gaz H2 znacząco hamował wzrost nowotworu żołądka in vivo oraz proliferację, migrację i ekspresję lncRNA MALAT1 i EZH2 komórek raka żołądka, jednocześnie zwiększając ekspresję miR-124-3p . Nadekspresja LncRNA MALAT1 zniosła wszystkie wyżej wymienione efekty H2 . LncRNA MALAT1 i miR-124-3p wzajemnie hamowały wzajemną ekspresję. MiR-124-3p naśladuje zniesiony lncRNA MALAT1 promujący ekspresję EZH2 oraz proliferację i migrację komórek raka żołądka.
Wnioski
Dane te wykazały, że H2 można opracować jako lek na raka żołądka, a oś lncRNA MALAT1/miR-124-3p/EZH2 może być celem interwencji.
Tło
Rak żołądka jest szóstym najczęściej występującym nowotworem z ponad milionem nowych przypadków na całym świecie w 2018 r. i powoduje drugą co do śmiertelności wśród nowotworów złośliwych [ 1 ]. Chociaż infekcja Helicobacter pylori jest najczęstszą przyczyną raka żołądka, wiele czynników żywieniowych i stylu życia, takich jak picie, palenie, aktywność fizyczna, nadwaga, spożycie owoców i warzyw, jest również istotnie powiązanych z rozwojem raka żołądka [ 2 ] . Genetycznie głównym onkogenem raka żołądka jest CDH1 (E-kadheryna), ponieważ wiele wariantów patogennych jest powiązanych z rodzinnym rakiem żołądka o charakterze rozlanym [ 3 , 4 ]. Jednakże wiele innych genów, w tym MSH2 , PMS2 ,,Stwierdzono, że BRCA1, PALB2, CTNNA1 i ATM zwiększają ryzyko raka żołądka [ 5 , 6 , 7 , 8 , 9 , 10 , 11 , 12 ].
Długie niekodujące RNA (lncRNA) to transkrypty większe niż 200 par zasad i podobne do mRNA pod względem biochemicznym i strukturalnym, ale nie kodują białek [ 13 ]. Wiele lncRNA powiązano z różnymi aspektami biologii raka [ 14 ]. Wykazano, że LncRNA MALAT1 (transkrypt 1 gruczolakoraka płuc związany z przerzutami) promuje proliferację i migrację komórek nowotworowych, przejście nabłonkowo-mezenchymalne i przerzuty wielu typów nowotworów, ale ostatnio odkryto, że działa jako supresor nowotworu w przypadku raka piersi i jelita grubego [ 16 ] LncRNA MALAT1 zwiększał łodygę, proliferację, migrację, inwazję i lekooporność komórek raka żołądka [ 17 , 18 , 19 ,20 ].
Chociaż stwierdzono, że wodór gazowy jest skuteczny w leczeniu raka płaskonabłonkowego myszy i uważa się, że można go zastosować w leczeniu innych nowotworów [ 21 ], jego zastosowanie kliniczne nie było szeroko badane aż do 2007 roku Ohsawa i in. wykazali, że gazowy wodór selektywnie eliminował rodnik hydroksylowy, a osłabienie ogniskowego niedokrwienia i reperfuzji powodowało stres oksydacyjny i uszkodzenie mózgu [ 22 ]. Coraz więcej dowodów wskazuje na potencjał gazowego wodoru w zapobieganiu różnym nowotworom i łagodzeniu ich [ 23 ]. Picie wody bogatej w wodór przez 6 tygodni zmniejszyło ilość reaktywnych metabolitów tlenu we krwi, utrzymało potencjał oksydacyjny krwi, poprawiło jakość życia chorych na złośliwego raka wątroby po radioterapii [ 24] Codzienna inhalacja wodoru przez 3 miesiące spowodowała zmniejszenie przerzutowego raka pęcherzyka żółciowego i poprawę jakości życia [ 25 ]. Celem tego badania jest zbadanie wpływu gazowego wodoru na komórki raka żołądka i leżącego u jego podstaw mechanizmu molekularnego.
Materiały i metody
Hodowlę komórkową
Linie komórkowe ludzkiego raka żołądka MGC-803 i BGC-823 zakupiono z kolekcji kultur typu Chińskiej Akademii Nauk (Szanghaj, Chiny). Komórki hodowano w temperaturze 37°C i 5% CO2 w zmodyfikowanej pożywce Eagle firmy Dulbecco (DMEM) uzupełnionej 10% płodową surowicą bydlęcą (FBS), 100 U/ml penicyliny i 100 µg/ml streptomycyny (wszystkie z ThermoFisher, ( Szanghai Chiny).
Mieszaninę gazowego wodoru/tlenu (66,7%:33,3% obj./obj.) wytworzono za pomocą generatora wodoru/tlenu (Asklepius Meditec, Szanghaj, Chiny). Obróbkę wodorem przeprowadzono w regulowanym inkubatorze do hodowli komórek z trzema gazami (Puhe Bio, Wuxi, Chiny). Wektor nadekspresyjny MALAT1 (GenScript, Nanjing, Chiny) i mimetyki miR-124-3p (GeneCopoeia, Guangzhou, Chiny) transfekowano przy użyciu Lipofectamine 3000 (ThermoFisher, Szanghaj, Chiny).
Test MTT
Posiano 5000 komórek MGC-803 lub BGC-823 na studzienkę w 96-studzienkowych płytkach i hodowano w temperaturze 37°C przez noc, a następnie poddano działaniu wodoru lub bez niego przez 24 godziny. Do każdej studzienki dodano 20 µl 5 mg/ml MTT (bromek 3-(4,5-dimetylotiazol-2-ilo)-2,5-difenylotetrazoliowy) i inkubowano w temperaturze 37°C przez 4 godziny. Pożywkę ostrożnie usunięto i do każdej studzienki dodano 100 µl rozpuszczalnika MTT (4 mM HCl i 0,1% Nondet P-40 (NP40) w izopropanolu). Płytki inkubowano w temperaturze pokojowej z wytrząsaniem orbitalnym przez 15 minut przed odczytem przy 590 nm.
Czy gojenie będzie testem zadrapań
Gdy komórki MGC-803 i BGC-823 na 24-studzienkowych płytkach osiągnęły konfluencję, komórki traktowano 0,2 mg/ml mitomycyny C przez 3 minuty. Środek studzienek zarysowano niebieską końcówką i sfotografowano. Następnie płytki hodowano w temperaturze 37°C przez 12 godzin i fotografowano. Luki mierzono za pomocą ImageJ (NIH, Bethesda, MD). Szybkość migracji obliczono jako (odległość przerwy w 0 godz. – odległość przerwy w 24 godz.)/odległość przerwy w 0 godz. *100.
Ilościowa reakcja łańcuchowa polimerazy w czasie rzeczywistym (RT-qPCR)
Całkowity RNA ekstrahowano przy użyciu zestawu do ekstrakcji MiniBEST Universal RNA Extraction Kit (TaKaRa, Pekin, Chiny) zgodnie z instrukcją producenta. Pierwszą nić cDNA zsyntetyzowano z 0,5 µg całkowitego RNA przy użyciu zestawu Invitrogen SuperScript III Reverse Transcriptase (ThermoFisher, Szanghaj, Chiny). Niekodujące małe RNA były najpierw poli(A) z ogonem E. coliPolimeraza poli(A) (M0276, NEB, Ipswich, MA), a następnie poddana odwrotnej transkrypcji przy użyciu odwrotnej transkryptazy wirusa białaczki myszy Moloneya (M-MuLV, MMLV) (M0253, NEB) z GTCGCAGTGCAGGGTCCGAGGTGCGATTTTTTTTTTTTTTTTTTTTTT(A/G/C)(A/G /T/C) jako podkład. Amplifikację RT-PCR w czasie rzeczywistym przeprowadzono na ABI StepOne Plus (Applied Biosystems, Foster City, Kalifornia) przy użyciu zestawu SYBR Premix Ex TaqTM (Takara, Pekin, Chiny). Starterami do PCR były TGCTGTGTGCCAATGTTTCG i CAGCTGCCTGCTGTTTTCTG dla MALAT1, CTGCTTCCTACATCGTAAGTGCAA i TTGCTCCCTCCAAATGCTGGT dla wzmacniacza podjednostki 2 represyjnego kompleksu zeste 2 Polycomb (EZH2), CTGAGGAGCAGCTTCAGTCC i GAGTAGCCATTGTCCACGCT dla β-kateniny ( CTNNB1) oraz CCGAGAATGGGAAGCTTGTC i AAGCACCAACGAGAGGAGAA dla dehydrogenazy aldehydu glicerynowo-3-fosforanowego (GAPDH ). TAAGGCACGCGGTGAATGC dla miR-124-3p i CGCAAGGATGACACGCAAATTC dla U6 z uniwersalnym podkładem zwrotnym GTGCAGGGTCCGAGGT. Względną ekspresję genów obliczono za pomocą 2− Metoda ΔΔCt z GAPDH jako kontrolą wewnętrzną dla lncRNA MALAT1 i EZH2 oraz U6 dla miR-124-3p.
Western blot
Komórki MGC-803 i BGC-823 poddano lizie buforem do lizy RIPA (1% v/v NP-40, 20 mM Tris-HCL pH 7,4, 5 mM pirofosforan sodu, 5 mM EDTA) uzupełnionym koktajlem inhibitorów proteazy i fosfatazy (Millipore Sigma, Burlington, MA). Próbki całkowitego białka (40 µg) rozdzielono na 8% żelach SDS-PAGE i przeniesiono na membrany PVDF. Błony blokowano w 5% odtłuszczonym mleku w TBST (50 mM Tris, pH 7,5; 150 mM NaCl; 0,1% Tween 20) przez 30 minut, inkubowano z przeciwciałami pierwszorzędowymi w temperaturze 4°C przez noc, przemywano i inkubowano z odpowiednią peroksydazą chrzanową skoniugowaną koza przeciwko mysim lub króliczym przeciwciałom IgG (Jackson ImmunoResearch, West Grove, PA) w temperaturze pokojowej przez 60 minut przed wizualizacją za pomocą odczynników o zwiększonej chemiluminescencji (ECL) (Pierce, Rockford, IL). Stosowanymi przeciwciałami pierwszorzędowymi były anty-EZH2 (05-1319,
Modele ksenoprzeszczepu żołądka u myszy
Protokół dotyczący zwierząt został zatwierdzony przez Instytucjonalną Komisję ds. Opieki i Wykorzystania Zwierząt Szpitala Zhongshan stowarzyszonego z Uniwersytetem Fudan (ZHFU20200374). Samice myszy BALB/c nude (w wieku 5 tygodni) zakupiono od Cavens Laboratory Animal Inc (Changzhou, Chiny) i aklimatyzowano przez tydzień. Komórki BGC-823 (1 x 106 ) stabilnie transfekowane lncRNA MALAT1 lub miR-124-3p wstrzyknięto podskórnie w bok nagiej myszy (n = 7). Trzy dni później myszy poddawano działaniu mieszaniny wodoru i tlenu (2:1 obj.:obj.) przez 2 godziny dziennie. Wszystkie myszy uśmiercono 5 tygodni po zaszczepieniu.
Analizy statystyczne
Wszystkie doświadczenia przeprowadzono 3 razy w trzech powtórzeniach. Analizy statystyczne przeprowadzono przy użyciu GraphPad Prism 6 (San Diego, Kalifornia). Różnice między sposobami leczenia oceniano za pomocą analizy wariancji, a następnie testów Bonferroniego. Wartość p mniejszą niż 0,05 uznawano za istotną statystycznie.
Wyniki
Wodór hamował proliferację i migrację komórek raka żołądka
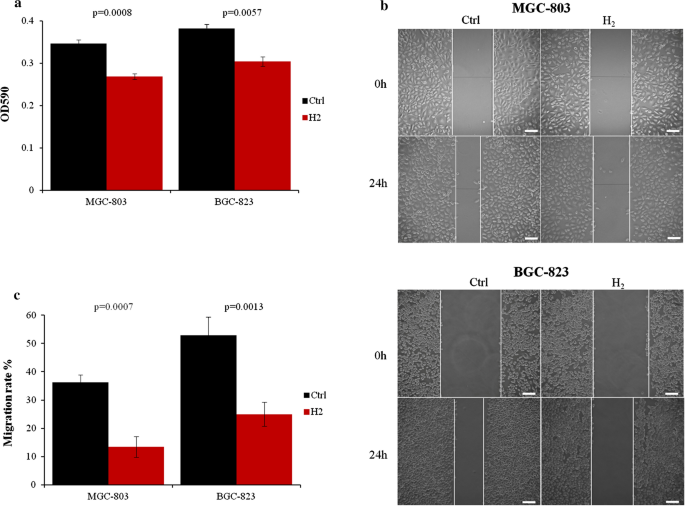
Ponieważ wykazano, że wodór hamuje postęp raka [ 25 ] i proliferację komórek raka płuc [ 26 ], najpierw sprawdziliśmy, czy może on mieć wpływ na proliferację komórek raka żołądka. Po 24-godzinnej ekspozycji na gazowy wodór liczba żywych komórek MGC-803 i BGC-823 zmniejszyła się o ponad 20% w porównaniu z normalnie hodowanymi komórkami (ryc. 1 a). Ponadto gaz H2 drastycznie zmniejszył ruchliwość komórek MGC-803 o około 60% i komórek BGC-823 o ponad 50% (ryc. 1 b, c).
Gazowy H2 hamował proliferację i migrację komórek raka żołądka . komórki MGC-803 i BGC-823 hodowano z lub bez H2 przez 24 godziny i oceniano za pomocą testu MTT. b Migrację komórek MGC-803 i BGC-823 oznaczono za pomocą testu gojenia się ran poprzez zadrapanie. c Analiza ilościowa danych migracyjnych. Pasek skali: 25 µm. Ctrl, Normalne warunki hodowli. *p < 0,01 w porównaniu do Ctrl
Gazowy wodór hamował ekspresję MALAT1 i EZH2
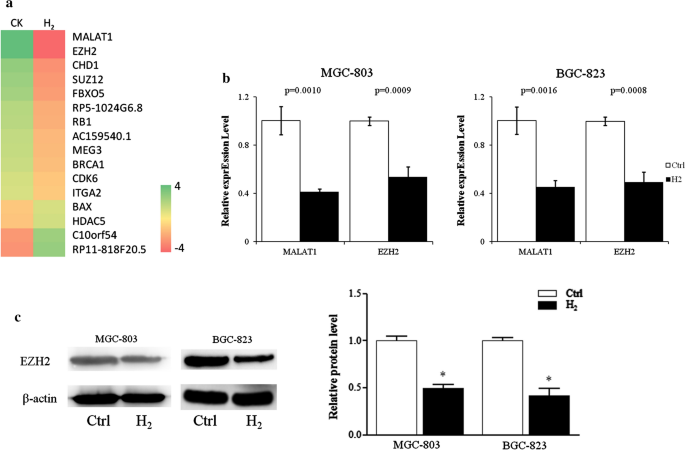
Analiza mikromacierzy wykazała, że gazowy H2 znacząco hamował ekspresję lncRNA MALAT1 i czynnika transkrypcyjnego EZH2 w komórkach MGC-823 (ryc. 2a ). Ilościowa PCR w czasie rzeczywistym potwierdziła, że 24-godzinna ekspozycja na H2 obniżyła poziomy transkryptów RNA MALAT1 i EZH2 o około 50% zarówno w komórkach MGC-803, jak i BGC-823 (ryc. 2 b). Poziomy białka EZH2 w komórkach MGC-803 i BGC-823 traktowanych H2 spadły o ponad 50% w porównaniu z komórkami kontrolnymi (Fig. 2c ).
Ekspresja lncRNA MALAT1 i jego genów docelowych w komórkach raka żołądka była hamowana przez H2 . Mapa cieplna genów o różnej ekspresji w komórkach MGC-803 hodowanych z H2 lub bez . b Poziomy transkryptu lncRNA MALAT1, EZH2 analizowano metodą ilościowej PCR w czasie rzeczywistym. c Poziomy białka EZH2 oceniano za pomocą immunoblotu. CK i Ctrl, Normalne warunki hodowli. *p < 0,01 w porównaniu do Ctrl
H2 hamował ekspresję EZH2 poprzez regulację w dół LncRNA MALAT1
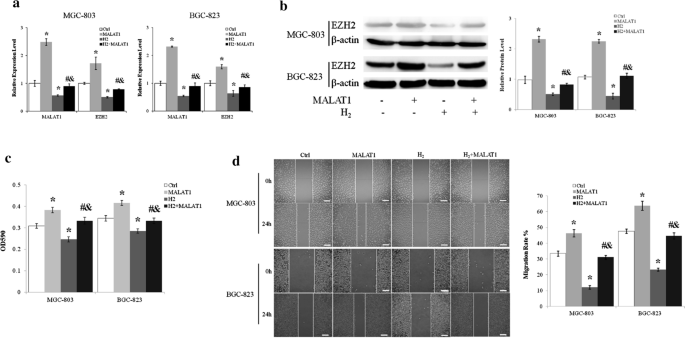
Nadekspresja MALAT1 zwiększyła poziom mRNA (ryc. 3 a) i białka (ryc. 3 b) EZH2 w komórkach MGC-803 i BGC-823. Ponadto LncRNA MALAT1 zniósł hamowanie ekspresji EZH2 przez H2 ( ryc. 3 a, b).
H2 hamował proliferację i migrację komórek raka żołądka poprzez regulację lncRNA MALAT1. a Poziomy transkryptu lncMALAT1 i EZH2 komórek MGC-803 mierzono metodą ilościowej PCR w czasie rzeczywistym. b Poziom białka EZH2 oceniano za pomocą immunoblotu. c Komórki MGC-803 i BGC-823 transfekowane wektorem ekspresyjnym lncRNA MALAT1 lub bez niego hodowano z H2 lub bez niego przez 24 godziny i oceniano za pomocą testu MTT. d Do zbadania wpływu H2 i lncRNA MALAT1 na migrację komórek MGC-803 i BGC-823 zastosowano test gojenia się ran poprzez zarysowanie . Pasek skali: 25 µm. Ctrl, Normalne warunki hodowli. *p < 0,01 w porównaniu do Ctrl; #p < 0,01 w porównaniu z MALAT1; & p < 0,01 w porównaniu z H2
LncRNA MALAT1 złagodził hamujący wpływ H2 na proliferację i migrację komórek raka żołądka
Jak wcześniej wykazano, że gazowy H2 hamuje proliferację i migrację komórek MGC-803 i BGC-823, następnie zbadaliśmy rolę LncRNA MALAT1 na wpływ H2 . Nadekspresja LncRNA MALAT1 spowodowała około 25% wzrost proliferacji komórek MGC-803 i BGC-823 (p < 0,01 MALAT1 vs. Ctrl) i zniosła hamowanie proliferacji narzucone przez H2 (p < 0,01 dla MALAT1 + H2 vs. MALAT1 i MALAT1 + H2 vs. H2 ) (Rys. 3c ). Nadekspresja LncRNA MALAT1 zwiększyła migrację komórek MGC-803 i BGC-823 o około 40% (p < 0,01 MALAT1 vs. Ctrl) (ryc. 3 D). Co więcej, MALAT1 znosił hamujący wpływ H2gazu na migrację komórek raka żołądka MGC-803 (p < 0,01 dla MALAT1 + H2 w porównaniu z MALAT1 i MALAT1 + H2 w porównaniu z H2 ) (ryc. 3 d).
Ekspresja miR-124-3p w komórkach raka żołądka była regulowana przez H2 i lncRNA MALAT1
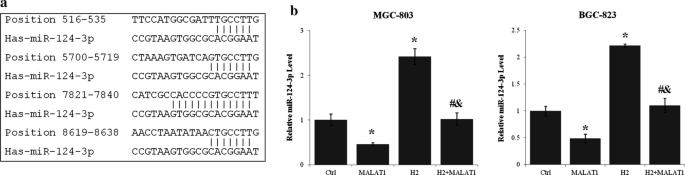
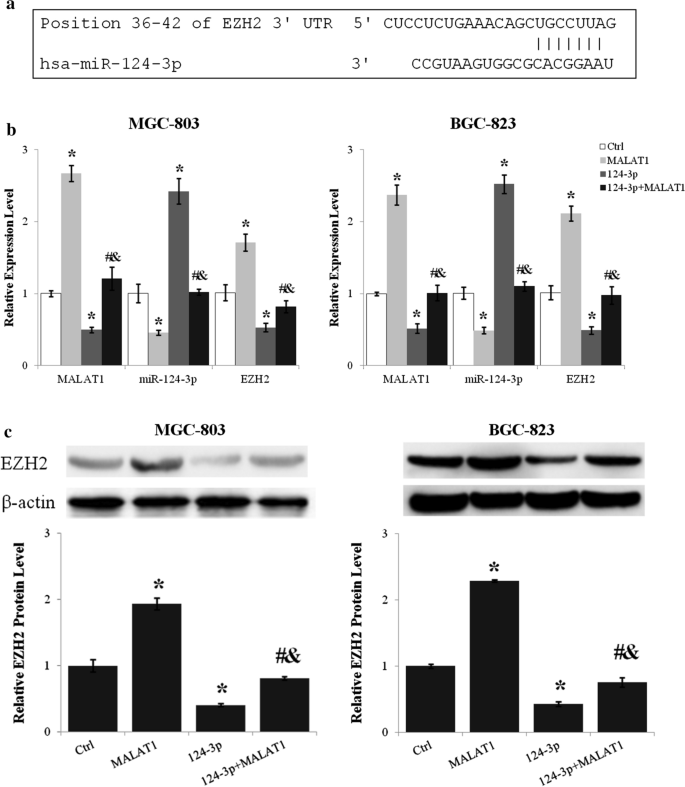
Przy użyciu LncBase Predicted v.2 ( http://carolina.imis.athena-innovation.gr/diana_tools ) zidentyfikowano has-miR-124-3p jako regulator i cel lncRNA MALAT1. W MALAT1 zidentyfikowano cztery silne miejsca wiązania miR-124-3p (ryc. 4 a) i wiele innych niedoskonałych miejsc wiązania miR-124-3p. Poziom miR-124-3p komórek MGC-803 i BGC-823 wzrósł o ponad 100% po traktowaniu H2 ( p < 0,01, H2 vs. Ctrl) (ryc. 4 b). Z drugiej strony nadekspresja lncRNA MALAT1 obniżyła poziom miR-124-3p o ponad 40% (p < 0,01 MALAT1 vs. Ctrl). Ponadto lncRNA MALAT1 i gaz H 2 antagonizowały wzajemne działanie na ekspresję miR-124-3p (p < 0,01 dla MALAT1 + H 2vs. MALAT1 i MALAT1 + H2 vs. H2 ) (Rys. 4 b).
LncRNA MALAT1 pośredniczył w wpływie H2 na ekspresję miR-124-3p w komórkach raka żołądka. a Miejsca wiązania miR-124-3p w sekwencji transkryptu lncRNA MALAT1 przewidziano przy użyciu LncBase Predicted v.2 Diana Tools. b Poziom ekspresji miR-124-3p w komórkach MGC-803 i BGC-823 transfekowanych wektorem ekspresyjnym lncRNA MALAT1 lub bez niego i hodowanych z H2 lub bez niego przez 24 godziny oznaczono metodą ilościowej PCR w czasie rzeczywistym. *p < 0,01 w porównaniu do kontroli; # p < 0,01 w porównaniu z MALAT1; & p < 0,01 w porównaniu z H2
LncRNA MALAT1 zwiększył ekspresję EZH2 poprzez hamowanie miR-124-3p
Ponieważ miR-124-3p był regulowany przez lncRNA MALAT1, a EZH2 zidentyfikowano jako bezpośredni cel miR-124-3p (ryc. 5 a), wpływ miR-124-3p na regulację ekspresji EZH2 przez lncRNA MALAT1 był oceniony. Transfekcja mimetyków miR-124-3p zmniejszyła poziom mRNA EZH2 o około 50% (p < 0,01, miR-124-3p vs. Ctrl) i zahamowała regulację w górę EZH2 przez lncRNA MALAT1 (p < 0,01 dla miR-124-3p + MALAT1 vs. MALAT1 i miR-124-3p + MALAT1 vs. miR-124-3p) (ryc. 5 b). Co więcej, lncRNA MALAT1 i miR-124-3p wzajemnie hamują wzajemną ekspresję (ryc. 5 )B). Poziom białka EZH2 został zmniejszony o około 60% przez miR-124-3p (p < 0,01, miR-124-3p vs. Ctrl), a miR-124-3p zniósł indukowaną przez lncRNA MALAT1 regulację w górę EZH2 (p < 0,01 dla miR- 124-3p + MALAT1 vs. MALAT1 i miR-124-3p + MALAT1 vs. miR-124-3p) (ryc. 5 c).
Zwiększenie poziomu EZH2 przez lncRNA MALAT1 było antagonizowane przez miR-124-3p. a Miejsce wiązania miR-124-3p w EZH2 3’UTR przewidywane przy użyciu TargetScan. b Poziomy ekspresji lncRNA MALAT1, miR-124-3p i EZH2 po nadekspresji lncRNA MALAT1 i/lub miR-124-3p analizowano metodą ilościowej PCR w czasie rzeczywistym. c Wpływ lncRNA MALAT1 i miR-124-3p na poziom białka EZH2 zbadano metodą Western blot. Ctrl, Normalne warunki hodowli. *p < 0,01 w porównaniu do kontroli; # p < 0,01 w porównaniu z MALAT1; & p < 0,01 w porównaniu do 124-3 p
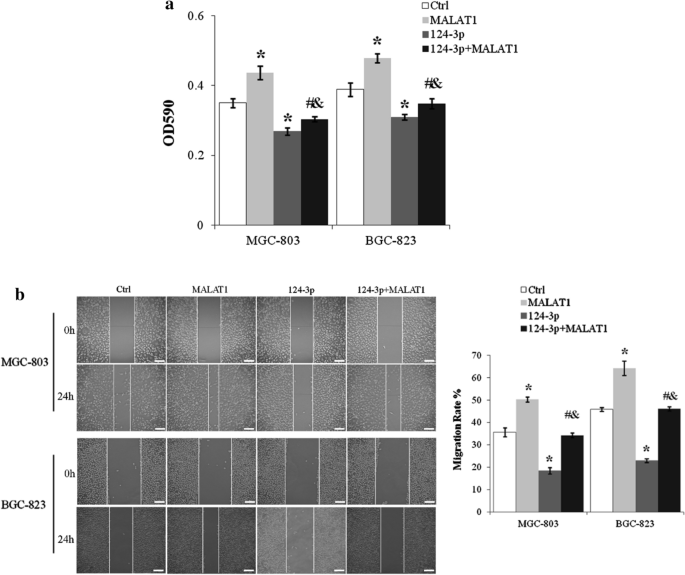
miR-124-3p zniósł lncRNA indukowany przez MALAT1 proliferację i migrację komórek raka żołądka
Żywotne komórki MGC-803 i BGC-823 zostały zredukowane o ponad 20% przez mimetyki miR-124-3p (p < 0,01, miR-124-3p vs. Ctrl) i promowanie proliferacji komórek MGC-803 i BGC-823 przez lncRNA MALAT1 był hamowany przez miR-124-3p (p < 0,01 dla miR-124-3p + MALAT1 vs. MALAT1 i miR-124-3p + MALAT1 vs. miR-124-3p) (ryc. 6 a ) . miR-124-3p hamował także tempo migracji komórek MGC-803 i BGC-823 o około 50% (p < 0,01, miR-124-3p vs. Ctrl) i znosił indukowany przez lncRNA MALAT1 wzrost ruchliwości komórek (p < 0,01 dla miR-124-3p + MALAT1 vs. MALAT1 i miR-124-3p + MALAT1 vs. miR-124-3p) (ryc. 6 b).
miR-124-3p blokował lncRNA MALAT1 indukował proliferację i migrację komórek raka żołądka. a Komórki MGC-803 transfekowane lncRNA MALAT1 i/lub miR-124-3p hodowano przez 24 godziny i oceniano za pomocą testu MTT. b Migrację komórek MGC-803 i BGC-823 z nadekspresją lncRNA MALAT1 i/lub miR-124-3p badano za pomocą testu gojenia się ran poprzez zadrapanie. Pasek skali: 25 µm. Ctrl, Normalne warunki hodowli. *p < 0,01 w porównaniu do kontroli; # p < 0,01 w porównaniu z MALAT1; & p < 0,01 w porównaniu do 124-3 p
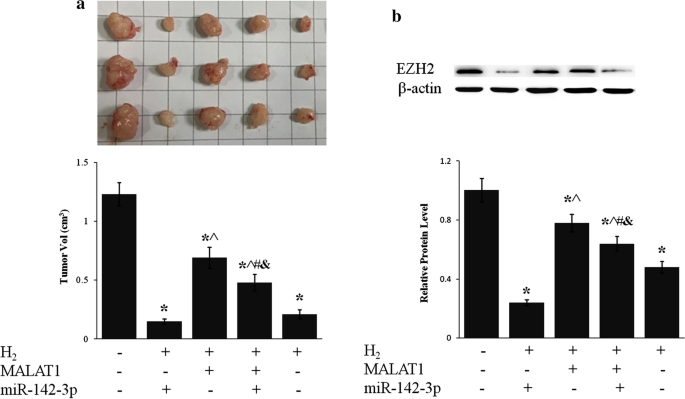
LncRNA MALAT1 i miR-124-3p pośredniczyły w hamowaniu wzrostu nowotworu przez H2
Wdychanie H 2 drastycznie hamowało wzrost nowotworu u myszy z heteroprzeszczepem komórek BGC-823 (p < 0,01, H 2 vs. Ctrl) (ryc. 7 ), co było zgodne z obserwacjami klinicznymi różnych nowotworów [ 23 , 25 ]. Nadekspresja lncRNA MALAT1 częściowo tłumiona H2 spowodowała zahamowanie wzrostu nowotworu, podczas gdy miR-124-3p przeciwdziałała działaniu lncR MALAT1 (ryc. 7 a). Poziom białka EZH2 w tkance nowotworu żołądka obniżył się o ponad 50% w wyniku ekspozycji na H2 , co zostało wzmocnione przez miR-124-3p i tłumione przez lncRNA MALAT1 (ryc. 7b ).
H2 hamował wzrost guza żołądka poprzez oś lncRNA MALAT1/miR-124-3p. Komórki BGC-823 stabilnie eksprymujące lncRNA MALAT1 i/lub miR-124-3p wszczepiono podskórnie nagim myszom. Następnie myszy wystawiano na działanie H2 przez 2 godziny dziennie przez 5 tygodni. a Pokazano obraz reprezentatywnych guzów (górny panel) i zmierzono wielkość guza (dolny panel). b Poziom białka EZH2 w tkance nowotworowej oceniano metodą Western blot. *p < 0,01 w porównaniu do Ctrl; ^ p < 0,01 w porównaniu z H2 + 124-3p; # p < 0,01 w porównaniu z H2 + MALAT1; & p < 0,01 w porównaniu z H2
Dyskusja
Gaz H2 hamował proliferację i migrację komórek raka żołądka MGC-803 i BGC-823 oraz obniżał ekspresję lncRNA MALAT1 i EZH2 . Hamowanie EZH2 przez H2 zostało złagodzone przez nadekspresję lncRNA MALAT1. LncRNA MALAT1 łagodził również H2, powodując hamowanie proliferacji i migracji komórek raka żołądka MGC-803 i BGC-823. MikroRNA hsa-miR-124-3p zidentyfikowano jako cel i regulator lncRNA MALAT1 i tłumił ekspresję EZH2. H2 zwiększył ekspresję miR-124-3p, która została zniesiona przez nadekspresję lncRNA MALAT1 . LncRNA MALAT1 promował proliferację i migrację komórek MGC-803 i BGC-823, które zostały zniesione przez mimetyki miR-124-3p. H 2ekspozycja drastycznie zmniejszyła wzrost raka żołądka w mysim modelu heteroprzeszczepu i zahamowała ekspresję EZH2 w tkance nowotworowej, która została wzmocniona przez miR-124-3p i tłumiona przez lncRNA MALAT1.
Wykazano, że gazowy H 2 poprawia wiele warunków poprzez usuwanie szkodliwych ROS [ 27 ]. Wdychanie wysokiego stężenia wodoru chroniło komórki zwojowe siatkówki szczura przed uszkodzeniem siatkówki związanym z niedokrwieniem/reperfuzją (I/R), powodując stres oksydacyjny, stan zapalny i apoptozę [28 ] . Wdychanie H 2 łagodziło okluzję tętnicy środkowej mózgu wywołane uszkodzeniem I/R mózgu, o czym świadczy zmniejszona produkcja 3-nitrotyrozyny i 8-hydroksy-2-deoksyguanozyny, złagodzenie stanu zapalnego i zmniejszona apoptoza nerwowa [ 29 ] . Wykazano, że sygnalizacja PI3K/AKT1 pośredniczy w ochronie H2 w przypadku urazów serca wywołanych I/R [ 30] U pacjentów ze złośliwym rakiem wątroby picie wody bogatej w wodór podczas radioterapii znacznie obniżyło poziom wodoronadtlenku we krwi i zwiększyło biologiczne działanie antyoksydacyjne, co doprowadziło do poprawy jakości życia [ 24 ]. Codzienna inhalacja H 2 zatrzymała wzrost guzów pierwotnych i przerzutowych u pacjenta z rakiem pęcherzyka żółciowego z przerzutami, a poziom biomarkerów nowotworowych powrócił do normy [ 25 ]. Traktowanie H2 hamowało ekspresję CD47 i indukowało apoptozę komórek raka płuc A549 [ 31 ] . Inne badanie wykazało, że SMC3 pośredniczy w hamowaniu progresji raka płuc przez H2 w badaniu in vitro i mysim modelu ksenoprzeszczepu [ 26 ]. Obecne badanie wykazało, że H2 może hamować postęp i migrację komórek raka żołądka. Uzasadnione są dalsze badania nad wpływem H2 na progresję raka żołądka w modelach zwierzęcych.
Długi niekodujący RNA MALAT1 zidentyfikowano jako czynnik związany z przerzutami niedrobnokomórkowego raka płuc [ 32 ] i regulujący ekspresję genów poprzez inny mechanizm [ 16 ]. LncRNA MALAT1 ulegał nadekspresji w rakach żołądka w porównaniu z sąsiadującą normalną tkanką i promował proliferację, migrację i oporność komórek raka żołądka na cisplatynę poprzez aktywację szlaku PI3K/AKT [ 19 , 33 ]. LncRNA MALAT1 regulował ekspresję miR-30e/ATG5 w celu modulowania autofagii i apoptozy komórek raka żołądka SGC7901 i nadawał oporność na cisplatynę [ 34 ]. Wykazano, że MALAT1 bezpośrednio wiąże się i stabilizuje mRNA Sox2, co prowadzi do wzrostu łodygi oraz chemio- i radiooporności komórek raka żołądka [20 ]. Obecne badanie wykazało, że lncRNA MALAT1 promuje proliferację i migrację raka żołądka poprzez modulowanie osi miR-124-3p/EZH2.
Poziom mikroRNA miR-124-3p był znacząco obniżony w tkankach raka żołądka, a jego poziom był odwrotnie zależny od stopnia histologicznego, stopnia zaawansowania TNM i przerzutów do węzłów chłonnych. Co więcej, niska ekspresja miR-124-3p była skorelowana z niższym współczynnikiem przeżycia całkowitego i przeżycia wolnego od choroby [ 35 ]. Stwierdzono, że ITGB3 [ 36 ] i ZEB1 [ 37 ] są celem miR-124-3p w promowaniu proliferacji i inwazji raka żołądka. Co więcej, Circular RNA circ-PVT1 zwiększał ekspresję ZEB1 poprzez pochłanianie miR-124-3p i zwiększał oporność na paklitaksel komórek nowotworu żołądka i raka żołądka [ 37 ]. LncRNA XIST i miR-124-3p kompetycyjnie regulowały ekspresję EZH2 i modulowały proliferację, migrację i inwazję komórek raka płaskonabłonkowego krtani [38 ]. miR-124-3p był antagonizowany przez lncRNA MALAT1 w hamowaniu ekspresji Slug i przerzutów raka wątrobowokomórkowego [ 39 ]. Badanie to wykazało, że gaz H2 hamował wzrost raka żołądka in vivo oraz proliferację i migrację komórek raka żołądka in vitro poprzez zmniejszenie poziomu lncRNA MALAT1, co z kolei zwiększyło ekspresję miR-124-3p i obniżyło ekspresję EZH2 (Fig. 8 ) .
Wnioski
Badanie to wykazało skuteczność wodoru molekularnego w hamowaniu wzrostu raka żołądka poprzez zmniejszenie proliferacji i migracji komórek raka żołądka, co nastąpiło poprzez obniżenie poziomu lncRNA MALAT1 i członka rodziny grupy Polycomb EZH2 oraz zwiększenie poziomu miR-124-3p. Co więcej, miR-124-3p hamował ekspresję EZH2 i wzajemnie tłumił ekspresję siebie nawzajem za pomocą lncRNA MALAT1. Dane te wskazują, że H2 powinien być dalej badany pod kątem leczenia raka żołądka, a oś lncRNA MALAT1/miR-124-3p/EZH2 byłaby nowym celem interwencji.
Dostępność danych i materiałów
Wszystkie dane wygenerowane lub przeanalizowane podczas tego badania zostały zawarte w manuskrypcie.
Skróty
- MTT:
- Bromek 3-(4,5-dimetylotiazol-2-ilo)-2,5-difenylotetrazoliowy
- lncRNA:
- Długie niekodujące RNA
- miRNA:
- MikroRNA
- MALAT1:
- Transkrypt gruczolakoraka płuc związany z przerzutami 1
- EZH2:
- Wzmacniacz podjednostki kompleksu represyjnego Zeste 2 Polycomb 2
- GAPDH:
- Dehydrogenaza 3-fosforanu aldehydu glicerynowego
Bibliografia
Bray F, Ferlay J, Soerjomataram I, Siegel RL, Torre LA, Jemal A. Globalne statystyki dotyczące nowotworów 2018: szacunki GLOBOCAN dotyczące częstości występowania i umieralności na całym świecie dla 36 nowotworów w 185 krajach. CA Rak J Clin. 2018;68(6):394–424.
Poorolajal J, Moradi L, Mohammadi Y, Cheraghi Z, Gohari-Ensaf F. Czynniki ryzyka raka żołądka: przegląd systematyczny i metaanaliza. Zdrowie Epidemiolu. 2020;42:e2020004.
Berx G, Staes K, van Hengel J, Molemans F, Bussemakers MJ, van Bokhoven A i in. Klonowanie i charakterystyka ludzkiego genu supresora inwazji E-kadheryny (CDH1). Genomika. 1995;26(2):281–9.
Brooks-Wilson AR, Kaurah P, Suriano G, Leach S, Senz J, Grehan N i in. Mutacje germinalne E-kadheryny w dziedzicznym rozlanym raku żołądka: ocena 42 nowych rodzin i przegląd genetycznych kryteriów przesiewowych. J Med Geneta. 2004;41(7):508–17.
Gaston D, Hansford S, Oliveira C, Nightingale M, Pinheiro H, Macgillivray C i in. Mutacje linii zarodkowej w MAP3K6 są powiązane z rodzinnym rakiem żołądka. PLoS Genet. 2014;10(10):e1004669.
Li J, Woods SL, Healey S, Beesley J, Chen X, Lee JS i in. Mutacje punktowe w eksonie 1B APC ujawniają gruczolakoraka żołądka i polipowatość proksymalną żołądka jako rodzinny wariant polipowatości gruczolakowatej. Jestem J Hum Genet. 2016;98(5):830–42.
Vogelaar IP, Ligtenberg MJ, van der Post RS, de Voer RM, Kets CM, Jansen TJ i in. Nawracająca kandydoza i rak żołądka o wczesnym początku u pacjenta z genetycznie zdefiniowanym częściowym defektem MYD88. Rak Fam. 2016;15(2):289–96.
Sahasrabudhe R, Lott P, Bohorquez M, Toal T, Estrada AP, Suarez JJ i in. Mutacje linii zarodkowej w PALB2, BRCA1 i RAD51C, które regulują naprawę rekombinacji DNA u pacjentów z rakiem żołądka. Gastroenterologia. 2017;152(5):983–6.e6.
Slavin T, Neuhausen SL, Rybak C, Solomon I, Nehoray B, Blazer K i in. Genetyczna podatność na raka żołądka w międzynarodowej sieci badawczej społeczności zajmującej się genomiką kliniczną nowotworów. Geneta raka. 2017;216–217:111–9.
Weren RDA, van der Post RS, Vogelaar IP, van Krieken JH, Spruijt L, Lubinski J i in. Rola aberracji linii zarodkowych wpływających na CTNNA1, MAP3K6 i MYD88 w podatności na raka żołądka. J Med Geneta. 2018;55(10):669–74.
Fewings E, Larionov A, Redman J, Goldgraben MA, Scarth J, Richardson S i in. Warianty chorobotwórcze linii zarodkowej w PALB2 i innych genach predysponujących do raka w rodzinach z dziedzicznym rozlanym rakiem żołądka bez mutacji CDH1: badanie sekwencjonowania całego egzomu. Lancet Gastroenterol Hepatol. 2018;3(7):489–98.
Tedaldi G, Pirini F, Tebaldi M, Zampiga V, Cangini I, Danesi R i in. Wielogenowe badanie panelowe zwiększa liczbę loci związanych z predyspozycją do raka żołądka. Raki. 2019;11(9):E1340.
Rinn JL, Chang HY. Regulacja genomu przez długie niekodujące RNA. Annu Rev Biochem. 2012;81:145–66.
Nakamura S, Kanda M, Kodera Y. Włączenie biomarkerów molekularnych do praktyki klinicznej raka żołądka. Ekspert Rev Anticancer Ther. 2019;19(9):757–71.
Connerty P, Lock RB, de Bock CE. Długie niekodujące RNA: główne regulatory stresu komórkowego w raku. Przedni Onkol. 2020;10:285.
Chen Q, Zhu C, Jin Y. Onkogenne i hamujące nowotwory funkcje długiego niekodującego RNA MALAT1: pojawiające się kontrowersje. Przedni Genet. 2020;11:93.
Zhang Z, Li M, Zhang Z. lncRNA MALAT1 moduluje oporność na oksaliplatynę raka żołądka poprzez gąbkowanie miR-22-3p. Onco celuje w to. 2020;13:1343–54.
Shao G, Zhao Z, Zhao W, Hu G, Zhang L, Li W i in. Długi niekodujący RNA MALAT1 aktywuje autofagię i promuje proliferację komórek poprzez obniżenie ekspresji mikroRNA-204 w raku żołądka. Oncol Lett. 2020;19(1):805–12.
Zhu K, Ren Q, Zhao Y. Nadekspresja lncRNA MALAT1 sprzyja proliferacji, migracji i inwazji raka żołądka poprzez aktywację szlaku PI3K/AKT. Oncol Lett. 2019;17(6):5335–42.
Xiao Y, Pan J, Geng Q, Wang G. LncRNA MALAT1 zwiększa łodygę komórek raka żołądka poprzez zwiększenie stabilności mRNA SOX2. FEBS Otwórz biografię. 2019;9(7):1212–22.
Dole M, Wilson FR, Fife WP. Hiperbaryczna terapia wodorowa: możliwa metoda leczenia raka. Nauka. 1975;190(4210):152–4.
Ohsawa I, Ishikawa M, Takahashi K, Watanabe M, Nishimaki K, Yamagata K i in. Wodór działa jako terapeutyczny przeciwutleniacz, selektywnie redukując cytotoksyczne rodniki tlenowe. Nat Med. 2007;13(6):688–94.
Li S, Liao R, Sheng X, Luo X, Zhang X, Wen X i in. Wodór gazowy w leczeniu nowotworów. Przedni Onkol. 2019;9:696.
Kang KM, Kang YN, Choi IB, Gu Y, Kawamura T, Toyoda Y i in. Wpływ picia wody bogatej w wodór na jakość życia pacjentów leczonych radioterapią z powodu nowotworów wątroby. Med Gas Res. 2011;1(1):11.
Chen JB, Pan ZB, Du DM, Qian W, Ma YY, Mu F i in. Terapia wodorem indukowała kurczenie się przerzutowego raka pęcherzyka żółciowego: opis przypadku. Światowe przypadki J Clin. 2019;7(15):2065–74.
Wang D, Wang L, Zhang Y, Zhao Y, Chen G. Wodór hamuje postęp raka płuc poprzez celowanie w SMC3. Biomed Farmakolog. 2018;104:788–97.
Ishibashi T. Skuteczność terapeutyczna wodoru cząsteczkowego: nowy wgląd mechanistyczny. Curr Pharm Des. 2019;25(9):946–55.
Wang R, Wu J, Chen Z, Xia F, Sun Q, Liu L. Kondycjonowanie końcowe wdychanym wodorem sprzyja przetrwaniu komórek zwojowych siatkówki w szczurzym modelu uszkodzenia niedokrwiennego / reperfuzyjnego siatkówki. Rozdzielczość mózgu 2016;1632:82–90.
Cui J, Chen X, Zhai X, Shi D, Zhang R, Zhi X i in. Wdychanie wodoru pochodzącego z elektrolizy wody łagodzi uszkodzenia niedokrwienno-reperfuzyjne mózgu u szczurów – możliwe nowe źródło wodoru do zastosowań klinicznych. Neuronauka. 2016;335:232–41.
Chen O, Cao Z, Li H, Ye Z, Zhang R, Zhang N i in. Wodór o wysokim stężeniu chroni serce myszy przed uszkodzeniem niedokrwiennym/reperfuzyjnym poprzez aktywację szlaku PI3K/Akt1. Republika Naukowa 2017;7(1):14871.
Meng J, Liu L, Wang D, Yan Z, Chen G. Wodór hamuje postęp raka płuc poprzez obniżenie poziomu CD47. Biosci Rep. 2020;40(4):BSR20192761.
Ji P, Diederichs S, Wang W, Böing S, Metzger R, Schneider PM i in. MALAT-1, nowy niekodujący RNA, i tymozyna beta4 pozwalają przewidzieć przerzuty i przeżycie niedrobnokomórkowego raka płuc we wczesnym stadium. Onkogen. 2003;22(39):8031–41.
Dai Q, Zhang T, Li C. LncRNA MALAT1 reguluje proliferację komórek i oporność na cisplatynę w raku żołądka poprzez szlak PI3K/AKT. Rak Manag Res. 2020;12:1929–39.
Zhang YF, Li CS, Zhou Y, Lu XH. Propofol zwiększa wrażliwość na cisplatynę poprzez oś lncRNA MALAT1/miR-30e/ATG5 poprzez tłumienie autofagii w raku żołądka. Nauka życia. 2020;244:117280.
Liu F, Hu H, Zhao J, Zhang Z, Ai X, Tang L i in. miR-124-3p działa jako potencjalny marker i hamuje wzrost guza w raku żołądka. Biomed Rep. 2018;9(2):147–55.
Wu Q, Zhong H, Jiao L, Wen Y, Zhou Y, Zhou J i in. MiR-124-3p hamuje migrację i inwazję raka żołądka, celując w ITGB3. Pathol Res Pract. 2020;216(1):152762.
Liu YY, Zhang LY, Du WZ. Okrągły RNA circ-PVT1 przyczynia się do oporności komórek raka żołądka na paklitaksel poprzez regulację ekspresji ZEB1 poprzez gąbkowanie miR-124-3p. Biosci Rep. 2019;39(12):BSR20193045.
Xiao D, Cui X, Wang X. Długi niekodujący RNA XIST zwiększa agresywność raka płaskonabłonkowego krtani poprzez regulację miR-124-3p/EZH2. Rozdzielczość komórki Exp. 2019;381(2):172–8.
Cui RJ, Fan JL, Lin YC, Pan YJ, Liu C, Wan JH i in. Dostępność miR-124-3p jest antagonizowana przez LncRNA-MALAT1 w przypadku przerzutów nowotworowych indukowanych przez ślimaka w raku wątrobowokomórkowym. Lek na raka 2019;8(14):6358–69.
Podziękowanie
Nie dotyczy.
Finansowanie
Nie dotyczy.
Deklaracje etyczne
Zatwierdzenie etyki i zgoda na udział
Nie dotyczy.
Zgoda na publikację
Nie dotyczy.
Konkurencyjne interesy
Autorzy nie deklarują potencjalnego konfliktu interesów.
Dodatkowe informacje
Notatka wydawcy
Springer Nature pozostaje neutralny w odniesieniu do roszczeń jurysdykcyjnych dotyczących opublikowanych map i powiązań instytucjonalnych.
Prawa i uprawnienia
Otwarty dostęp Ten artykuł jest objęty licencją Creative Commons Uznanie autorstwa 4.0, która pozwala na używanie, udostępnianie, adaptację, dystrybucję i reprodukcję na dowolnym nośniku lub w dowolnym formacie, pod warunkiem odpowiedniego podania oryginalnego autora (autorów) i źródła, podaj link do licencji Creative Commons i wskaż, czy wprowadzono zmiany. Obrazy lub inne materiały stron trzecich zawarte w tym artykule są objęte licencją Creative Commons artykułu, chyba że w linii kredytowej dotyczącej materiału wskazano inaczej. Jeśli materiał nie jest objęty licencją Creative Commons artykułu, a zamierzone użycie jest niezgodne z przepisami ustawowymi lub przekracza dozwolone użycie, konieczne będzie uzyskanie zgody bezpośrednio od właściciela praw autorskich. Aby wyświetlić kopię tej licencji, odwiedź stronęhttp://creativecommons.org/licenses/by/4.0/ . Zrzeczenie się prawa do udostępniania domeny publicznej Creative Commons ( http://creativecommons.org/publicdomain/zero/1.0/ ) ma zastosowanie do danych udostępnionych w tym artykule, chyba że w linii kredytowej dla danych określono inaczej.